| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Alkali-Elemente Alkali-Elemente  Kalium Kalium  Kaliumhydroxid Kaliumhydroxid |
|||||||||||||||||
| Siehe auch: Kalium, Natriumhydroxid | |||||||||||||||||






|
|||||||||||||||||
Kaliumhydroxid (Kalilauge)Autor: Hans Lohninger
Kaliumhydroxid ("Ätzkali"), KOH, ist eine farblose, stark alkalische Substanz, die neben Natriumhydroxid als Prototyp einer Base gilt. Kaliumhydroxid ist sehr gut wasserlöslich, die wässrige Lösung nennt man Kalilauge. KOH ist wie NaOH hygroskopisch und zerfließt an der Luft. KOH löst sich auch gut in Ethanol und Glyzerin. Kaliumhydroxid kommt in Plätzchenform oder in Stabform in den Handel und muss aufgrund seiner hygroskopischen Eigenschaften in luftdichten Gefäßen oder Säcken aufbewahrt werden.
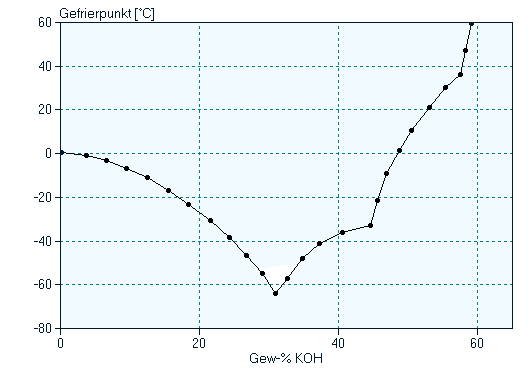
Löst man KOH in Wasser, so zeigt sich eine sehr starke Gefrierpunktserniedrigung. Das Eutektikum von KOH und Wasser liegt bei 31 Gew.-% KOH und weist einen Gefrierpunkt von -65°C auf.
HerstellungWeltweit werden jährlich etwa 800000 Tonnen Kaliumhydroxid hergestellt. Es wird heute großteils durch Elektrolyse einer wässrigen Lösung von Kaliumchlorid erzeugt (vergl. die Chloralkali-Elektrolyse):
2 H2O + 2 KCl
K2CO3 + Ca(OH)2
AnwendungKaliumhydroxid weist eine Vielzahl von Anwendungen auf, von denen die wichtigsten im Folgenden kurz aufgezählt seien:
|
|||||||||||||||||
Home  Alkali-Elemente Alkali-Elemente  Kalium Kalium  Kaliumhydroxid Kaliumhydroxid |
|||||||||||||||||
Last Update: 2013-08-08


 H2 + 2 KOH + Cl2
H2 + 2 KOH + Cl2