| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Kohlenstoffgruppe Kohlenstoffgruppe  Kohlenstoff Kohlenstoff  Kohlendioxid Kohlendioxid |
|||||||||||||||
| Siehe auch: Kohlenmonoxid, Calciumcarbonat, Carbonate | |||||||||||||||






|
|||||||||||||||
KohlendioxidAutor: Hans Lohninger
Kohlendioxid, CO2, ist ein farbloses, nicht brennbares, geruchloses Gas. Da die Dichte von Kohlendioxid deutlich höher als die von Luft ist, kann man Kohlendioxid umgießen. In Gärkellern sammelt es sich am Boden. Da CO2 jede Verbrennung erstickt, wird es in Feuerlöschern (CO2-Schaum) eingesetzt. Kohlendioxid kommt in der Natur sowohl in freier Form (in der Atmosphäre und gelöst in Wasser) vor, als auch in riesigen Mengen in gebundener Form als Calcium- und Magnesiumcarbonat. Wie man dem Phasendiagramm von Kohlendioxid entnehmen kann, existiert flüssiges CO2 nur bei Drücken oberhalb von 5.19 bar, darunter sublimiert festes Kohlendioxid ("Trockeneis", Sublimationspunkt bei Normaldruck: -78.5°C). Am Tripelpunkt bei 5.19 bar und -56.6 °C existieren alle drei Phasen im Gleichgewicht. Oberhalb des kritischen Punkts bei 31°C und 73.8 bar kann zwischen flüssiger und gasförmiger Phase nicht mehr unterschieden werden (überkritischer Zustand). Erst bei sehr viel höheren Drücken im Bereich von einigen tausend bar erstarrt dann auch überkritisches Kohlendioxid.
Im Labor wird Kohlendioxid am einfachsten aus Calciumcarbonat durch Salzsäure freigesetzt (mit Hilfe des Kipp'schen Apparats):
CaCO3 + 2 HCl
C + O2
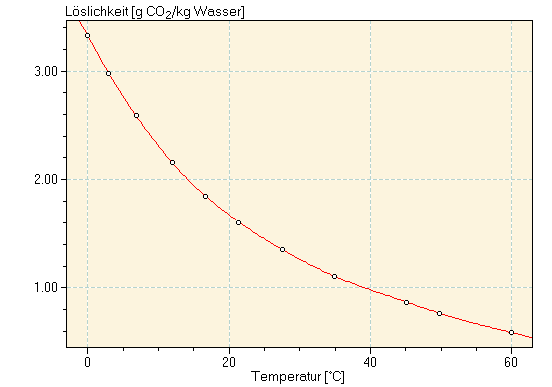
CO + H2O Die Löslichkeit von Kohlendioxid in Wasser ist nicht besonders hoch und stark von Druck und Temperatur abhängig. CO2 ist in organischen Lösungsmitteln deutlich besser löslich als in Wasser (so ist die Löslichkeit z.B. in Aceton um den Faktor 10 höher). Das folgende Diagramm zeigt die Temperaturabhängigkeit der Wasserlöslichkeit bei 1 atm:
Eine wässrige Lösung von Kohlendioxid reagiert sauer, da sich ein kleiner Teil des gelösten CO2 mit Wasser zu Kohlensäure, H2CO3, umsetzt. Kohlendioxid ist eine sehr stabile Substanz, die beim Erhitzen erst bei sehr hohen Temperaturen (ab 1200°C) in Kohlenmonoxid und Sauerstoff zerfällt (bei 2300°C sind erst ca. 20% zerfallen).
|
|||||||||||||||
Home  Kohlenstoffgruppe Kohlenstoffgruppe  Kohlenstoff Kohlenstoff  Kohlendioxid Kohlendioxid |
|||||||||||||||
Last Update: 2013-08-20



 CaCl2 + H2O + CO2
CaCl2 + H2O + CO2