| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Grundlegende Begriffe Grundlegende Begriffe  Schmelzdiagramme von Zweistoffsystemen Schmelzdiagramme von Zweistoffsystemen |
|
| Siehe auch: Legierungen - Grundlagen, Martensitische Umwandlung | |






|
|
Schmelzdiagramme von ZweistoffsystemenAutor: Hans Lohninger
Bei Zweistoffsystemen kennt man einige Basistypen von Legierungen, die sich durch ihr Lösungsverhalten (Mischbarkeitsverhalten) im festen Zustand unterscheiden: vollständige Löslichkeit, vollständige Unlöslichkeit, partielle Löslichkeit und Verbindungsbildung. Das Lösungsverhalten der Legierungen äußert sich durch ein jeweils charakteristisches Schmelzdiagramm.
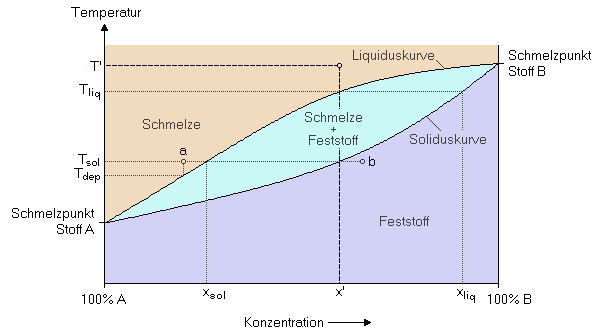
Vollständige Mischbarbeit im festen ZustandDas einfachste Verhalten eines Zweistoffsystems liegt vor, wenn die beiden Stoffe A und B nicht nur im flüssigen, sondern auch im festen Zustand beliebig mischbar sind. Beispiele dafür sind Kupfer/Nickel oder Germanium/Silizium.Zur Erklärung des Verhaltens einer solchen flüssigen Mischung beim Abkühlen, nehmen wir an, dass das flüssige Gemisch eine Zusammensetzung von x' und eine Temperatur von T' aufweist. Kühlt man diese Mischung ab, so werden sich bei der Temperatur Tliq die ersten festen Kristalle ausscheiden. Diese weisen eine Zusammensetzung von xliq auf, sind also reicher an Stoff B als die Schmelze. Dadurch wird der Schmelze der Stoff B entzogen, wodurch die Zusammensetzung der Schmelze bei weiterer Abkühlung entlang der Liquiduskurve nach links wandert. Erreicht die Temperatur den Wert Tsol ist die gesamte Schmelze erstarrt, die letzten sich noch bildenden Kristalle weisen eine Zusammensetzung von x' auf.
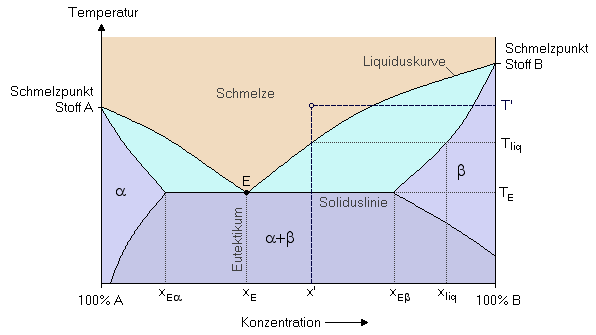
Vollständige Unmischbarkeit im festen ZustandBei gänzlicher Unmischbarkeit der festen Phase bildet sich ein spezieller Punkt im Schmelzdiagramm aus, das sogenannte Eutektikum. Das Eutektikum ist durch den Schnittpunkt der beiden Liquiduskurven bestimmt. Beispiele für dieses Verhalten sind die Systeme Antimon/Blei, Silber/Blei, oder auch Silbernitrat/Wasser.
Partielle Mischbarbeit im festen ZustandIn vielen Fällen sind die festen Phasen nicht vollkommen unmischbar, sondern es gibt eine begrenzte Löslichkeit sowohl von Stoff A in B, als auch umgekehrt (z.B. Kupfer/Gold). Dadurch ergeben sich im Phasendiagramm drei Bereiche für den festen Zustand: im Bereich α ist Stoff B in A gelöst, im Bereich β A in B, und im Bereich α+β existieren zwei gesättigte feste Lösungen (A in B und B in A) nebeneinander.
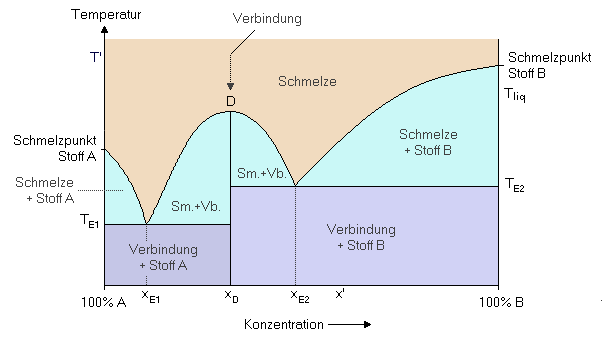
Verbindungsbildung im festen ZustandFalls die beiden Substanzen A und B eine Verbindung bilden (wie z.B. im System Magnesium/Zink bei der sich MgZn2 bildet), sieht man sehr oft Schmelzdiagramme, die formal aus einer Aneinanderreihung zweier Schmelzdiagramme mit Eutektikum (TE1 und TE2) bestehen. An der Verbindungsstelle der beiden Diagramme entsteht ein Maximum der Liquiduskurve, das man Dystektikum nennt. Das Dystektikum D entspricht der im festen Zustand entstehenden Verbindung mit der Zusammensetzung xD.
|
|
Home  Grundlegende Begriffe Grundlegende Begriffe  Schmelzdiagramme von Zweistoffsystemen Schmelzdiagramme von Zweistoffsystemen |
|
Last Update: 2013-08-08