| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Alkali-Elemente Alkali-Elemente  Natrium Natrium  Natriumsulfat Natriumsulfat |
||||||||||||||||||
| Siehe auch: Glaubersalz als Abführmittel, Meerwasser | ||||||||||||||||||






|
||||||||||||||||||
Natriumsulfat (Glaubersalz)Autor: H. Lohninger
Natriumsulfat ist eine kristalline, weiße Verbindung von Natrium, die entweder als wasserfreies Na2SO4 oder als Dekahydrat, Na2SO4
Physikalische und chemische EigenschaftenNatriumsulfat ist chemisch beständig und reagiert bei Raumtemperatur nicht oder kaum mit oxidierenden oder reduzierenden Reagentien. Bei hohen Temperaturen kann es zu Natriumsulfid reduziert werden. Eine Natriumsulfatlösung weist einen neutralen pH-Wert von 7 auf, da es das Salz einer starken Base mit einer starken Säure ist. In wässriger Lösung reagiert Natriumsulfat mit Schwefelsäure in einer Gleichgewichtsreaktion zu Natriumhydrogensulfat: Na2SO4(aq) + H2SO4(aq) Mischt man eine wässrige Lösung von Na2SO4 mit wässrigen Lösungen von Barium- oder Bleisalzen, so fällt ein Niederschlag aus, da sowohl Barium als auch Blei unlösliche Sulfate bilden:
Na2SO4(aq) + BaCl2(aq)
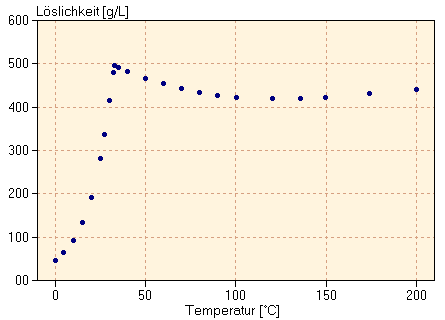
Die ungewöhnliche Veränderung des Lösungsverhaltens kann mit der Hydratation erklärt werden, da Natriumsulfat unterhalb von 32.4°C als Dekahydrat (Glaubersalz) kristalliert, oberhalb aber wasserfrei als Anhydrat (Thenardit). Da die Lösungswärmen der beiden Formen sich massiv unterscheiden (Thenardit löst sich unter Wärmeentwicklung, Glaubersalz unter Wärmeverbrauch), entsteht in Summe diese eigenartige Löslichkeitskurve.
Vorkommen und HerstellungEtwa die Hälfte des weltweiten Verbrauchs an Natriumsulfat wird aus Mirabilit und Thenardit gewonnen, das in großen Lagerstätten im südlichen Saskatchewan (Canada), am Kaspischen Meer (in Turkmenistan) und in Nevada (USA) vorkommt.Natriumsulfat fällt auch als Nebenprodukt bei vielen industriellen Prozessen an, von denen der wichtigste die Produktion von Salzsäure aus Natriumchlorid und Schwefelsäure ist:
2 NaCl + H2SO4 Diese Reaktion ist gleichzeitig die Vorstufe zum Leblanc-Prozess zur Herstellung von Soda (Natriumcarbonat). Als Alternative kann Natriumsulfat auch mit Hilfe des Hargreaves-Prozesses erzeugt werden:
4 NaCl + 2 SO2 + O2 + 2 H2O Weiters fällt Natriumsulfat als Nebenprodukt bei allen Prozessen an, bei denen Schwefelsäure mit Natriumhydroxid neutralisiert wird. Diese Methode ist auch das gängigste Verfahren zur Darstellung von Na2SO4 im Labor:
2 NaOH(aq) + H2SO4(aq) Na2SO4 wird normalerweise in Form des Dekahydrats durch Umkristallisieren gereinigt, da das Anhydrat dazu neigt, Eisen- und organische Verbindungen zu adsorbieren. Das Anhydrat kann einfach durch Erwärmen aus dem Dekahydrat gewonnen werden.
VerwendungNatriumsulfat wird in der Glas-, Papier-, Zellstoff- und Waschmittelindustrie eingesetzt. Bei der Glasherstellung dient Na2SO4 als Flussmittel, damit das geschmolzene Glas dünnflüssiger wird und Blasen- und Schaumbildung vermieden wird. Großverbraucher von Na2SO4 sind die Waschmittelhersteller, die es als Füllmittel für Waschpulver verwenden. In der Papierindustrie wird mit heißen alkalischen Lösungen Lignin aus Holz gelöst und so die Cellulose freigesetzt.Glaubersalz diente und dient als Abführmittel; es existieren auch Vorschläge, die Kristallisationswärme (78.2 kJ/mol) zum Speichern von Sonnenenergie zu verwenden, allerdings hat sich das Verfahren noch nicht durchgesetzt. Wasserfreies Natriumsulfat ist ein mildes Trockenmittel für organische Lösungsmittel.
|
||||||||||||||||||
Home  Alkali-Elemente Alkali-Elemente  Natrium Natrium  Natriumsulfat Natriumsulfat |
||||||||||||||||||
Last Update: 2013-08-08


 10H2O, auftritt. Das Dekahydrat ist auch unter der Bezeichnung
10H2O, auftritt. Das Dekahydrat ist auch unter der Bezeichnung  2 NaHSO4(aq)
2 NaHSO4(aq)
 2 NaCl(aq) + BaSO4(s)
2 NaCl(aq) + BaSO4(s)