| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Grundlegende Begriffe Grundlegende Begriffe  Mischkristalle und Doppelsalze Mischkristalle und Doppelsalze |
|||||||||||||||||||






|
|||||||||||||||||||
Mischkristalle und DoppelsalzeAutor: Hans Lohninger Viele anorganische Substanzen weisen eine gewisse Mischbarkeit auf atomarer/molekularer Ebene auf, so dass sich einheitliche Kristalle ergeben, die aber unterschiedliche Zusammensetzung aufweisen können. Im Gegensatz dazu stehen Doppelsalze, die keine Mischungen darstellen sondern Verbindungen mit klaren stöchiometrischen Verhältnissen. Als Beispiel für den Unterschied von Mischkristallen und Doppelsalzen sei die Mischung aus gleichen molaren Mengen Magnesit und Calcit einerseits, und Dolomit andererseits angegeben. Obwohl beide Systeme die gleiche Bruttozusammensetzung aufweisen, liegt im ersten Fall einfach eine physikalische Mischung der beiden Einzelkomponenten vor, und im zweiten Fall eine echte chemische Bindung:
MischkristalleGrundsätzlich gibt es zwei Arten von Mischkristallen: Substitutionsmischkristalle, bei denen eine Atomart durch eine andere Ersetz wird, und Einlagerungsmischkristalle, bei denen Fremdatome auf den Zwischengitterplätzen eingelagert werden. Einlagerungsmischkristalle nennt man auch interstitielle Lösungen:
Im allgemeinen treten bei Mischkristallen auch Mischungslücken auf, so dass nicht beliebige Mischungen erzeugt werden können. Kohlenstoff kann z.B. in α-Eisen nur in geringen Mengen gelöst werden, bei höheren Kohlenstoffkonzentrationen bildet sich im Eisen explizit Zementit.
DoppelsalzeDoppelsalze weisen immer eine stöchiometrische Zusammensetzung auf, da die Grundlage der Kristalle eine eindeutige chemische Bindung ist. In Lösung sind (im Gegensatz zu Komplexen) die Doppelsalze jedoch in die einzelnen Ionen dissoziiert.
Beispiele von Mischkristallen und Doppelsalzen:
|
|||||||||||||||||||
Home  Grundlegende Begriffe Grundlegende Begriffe  Mischkristalle und Doppelsalze Mischkristalle und Doppelsalze |
|||||||||||||||||||
Last Update: 2013-08-08




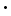 12H2O
12H2O