| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Grundlegende Begriffe Grundlegende Begriffe  pT-Phasendiagramm von Reinstoffen pT-Phasendiagramm von Reinstoffen |
|||||
| Siehe auch: Phasenumwandlung, Phasendiagramm, Dampfdruck von Eis und Wasser | |||||






|
|||||
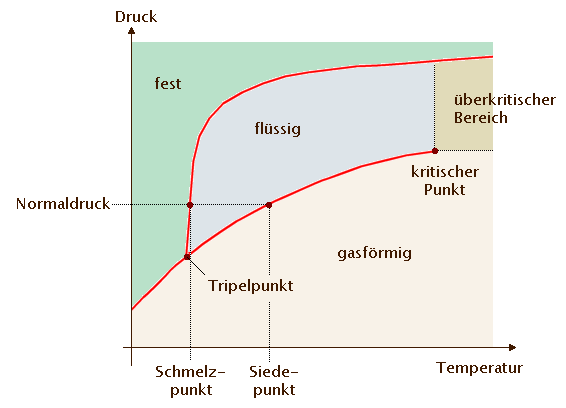
pT-Phasendiagramm von ReinstoffenAutor: Hans Lohninger Das pT-Zustandsdiagramm (oder auch pT-Phasendiagramm) stellt die Aggregatzustände einer Reinsubstanz in Abhängigkeit von Druck und Temperatur dar. Aus dem Phasendiagramm kann man den Schmelzpunkt, den Siedepunkt, den Sublimationspunkt, den kritischen Punkt und den Tripelpunkt ablesen. Das folgende typische pT-Diagramm zeigt diese Punkte.
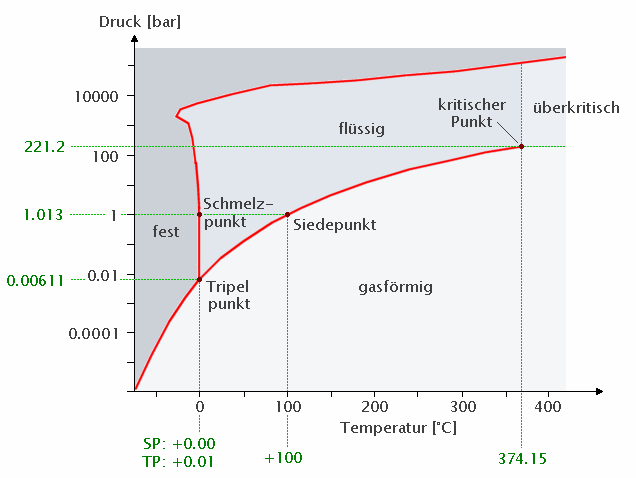
Wichtig ist es zu beachten, dass man den Schmelz- und den Siedepunkt normalerweise bei Normaldruck (1 atm = 1.013 bar) misst und angibt. Es gibt allerdings Substanzen (wie z.B. Kohlendioxid) die bei Normaldruck weder einen Schmelzpunkt noch einen Siedepunkt aufweisen, sondern nur einen Sublimationspunkt, da es bei Normaldruck keine flüssige Form gibt. Eine weitere Besonderheit im Phasendiagramm ist der überkritische Bereich. Eine Substanz bei Drücken und Temperaturen, die in diesen Bereich fallen, ist weder flüssig noch gasförmig (in dem Sinn, dass es einen klaren Übergang zwischen flüssig und gasförmig gibt, der sich durch einen Sprung in der Dichte der Substanz auswirkt).
BeispieleDas folgende pT-Phasendiagramm von Kohlendioxid zeigt sehr schön, dass CO2 bei Normaldruck nicht flüssig wird, da der Tripelpunkt einen Druck von 5.19 bar aufweist. Man muss also Kohlendioxid mindest auf 5.19 bar komprimieren, damit es verflüssigt werden kann. Bei Normaldruck geht es direkt von der festen Phase in die Gasphase über (Sublimation).
Das pT-Zustandsdiagramm für Wasser zeigt ein ungewöhnliches Verhalten der Grenzlinie zwischen fest und flüssig. Während normalerweise die Erhöhung des Drucks zu einer Erhöhung des Schmelzpunkts führt, ist es bei Wasser bei Drücken unterhalb von ca. 2000 bar genau umgekehrt.
|
|||||
Home  Grundlegende Begriffe Grundlegende Begriffe  pT-Phasendiagramm von Reinstoffen pT-Phasendiagramm von Reinstoffen |
|||||
Last Update: 2013-08-08