| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Übergangselemente Übergangselemente  Kupfergruppe Kupfergruppe  Kupfer Kupfer  Schmelzmetallurgische Gewinnung Schmelzmetallurgische Gewinnung |
|
| Siehe auch: Kupfer | |






|
|
Schmelzmetallurgische Gewinnung von KupferAutor: H. Lohninger Die schmelzmetallurgische Gewinnung von Kupfer ("pyrometallurgisches Verfahren") geht von eisenhaltigen Kupfersulfiderzen aus. Der Prozess vom Kupfererz bis zum Reinkupfer ist ein vielstufiger Prozess der im Folgenden kurz beschrieben wird (siehe Prozessdiagramm rechts). 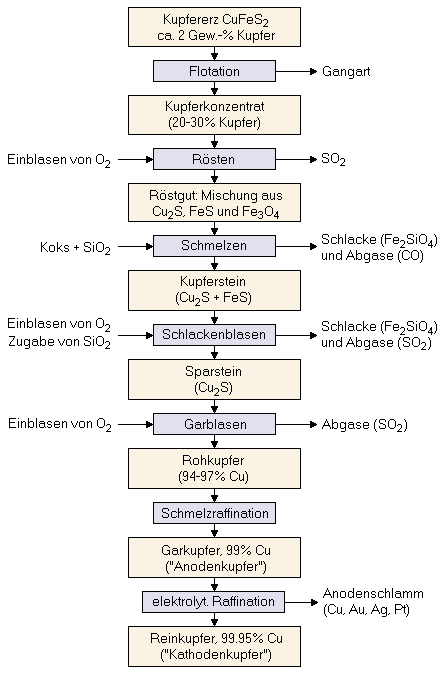 Da die meisten sulfidischen Kupfererze meist nur einen geringen Kupfergehalt aufweisen (typ. 2%), muss vor der metallurgischen Verarbeitung das Erz durch Flotation aufkonzentriert werden. Dabei wird das gemahlene Ausgangsmaterial in ein Bad mit Wasser und Holzteeröl gegeben, das stark schäumt. Das Öl benetzt die Teilchen mit dem Kupfererz wodurch diese im oben schwimmenden Ölschaum mitgenommen werden, während die Gangart im Wasser darunter zu Boden sinkt. Der Ölschaum wird dann ausgepresst und das Öl wieder dem Prozess zugeführt. Der Presskuchen enthält das angereicherte Kupfererz.
Da die meisten sulfidischen Kupfererze meist nur einen geringen Kupfergehalt aufweisen (typ. 2%), muss vor der metallurgischen Verarbeitung das Erz durch Flotation aufkonzentriert werden. Dabei wird das gemahlene Ausgangsmaterial in ein Bad mit Wasser und Holzteeröl gegeben, das stark schäumt. Das Öl benetzt die Teilchen mit dem Kupfererz wodurch diese im oben schwimmenden Ölschaum mitgenommen werden, während die Gangart im Wasser darunter zu Boden sinkt. Der Ölschaum wird dann ausgepresst und das Öl wieder dem Prozess zugeführt. Der Presskuchen enthält das angereicherte Kupfererz.
Das so aufkonzentrierte Erz (ca. 25% Kupferanteil) wird in einem ersten Schritt durch Sauerstoff bei ca. 750°C oxidiert (Rösten), wobei nur das im Erz enthaltene Eisensulfid oxidiert wird:
6 CuFeS2 + 13 O2 Der Kupferstein wird nun von enthaltenem Eisensulfid durch Einblasen von Sauerstoff und Zugabe von Quarz getrennt (ebenfalls Schlackenbildung nach der Oxidation des Eisensulfids).
2 FeS + 3 O2
2 Cu2S + 3 O2
Der letzte Reinigungsschritt erfolgt nun elektrolytisch mit Kupfersulfat als Elektrolyt, wobei das Garkupfer als Anode eingesetzt wird und sich im Laufe der Elektrolyse auflöst. An der Kathode scheidet sich Kupfer mit einer Reinheit von 99.95% ab ("Kathodenkupfer"). Im Schlamm unterhalb der aufgelösten Anode befinden sich Selen, Tellur und die Edelmetalle, die in weiterer Folge aus dem Anodenschlamm extrahiert werden.
|
|
Home  Übergangselemente Übergangselemente  Kupfergruppe Kupfergruppe  Kupfer Kupfer  Schmelzmetallurgische Gewinnung Schmelzmetallurgische Gewinnung |
|
Last Update: 2013-08-08


