| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Kohlenstoffgruppe Kohlenstoffgruppe  Silizium Silizium  Siliziumcarbid Siliziumcarbid |
|||||
| Siehe auch: Silizium, Wolframcarbid, Calciumcarbid, Borcarbid, Schleifmittel | |||||






|
|||||
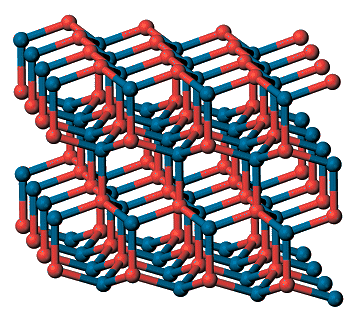
SiliziumcarbidAutor: Hans Lohninger Siliziumcarbid (Carborundum), SiC, bildet wie Kohlenstoff ein Diamantgitter und ist sehr hart (Mohs-Härte >9). Es kommt in zwei Modifikationen vor: α-SiC mit Wurtzitstruktur und β-SiC mit Sphaleritstruktur.
Reines SiC ist farblos, technisches Siliziumcarbid ist wegen der Verunreinigung mit Al2O3 schwarzgrün. Siliziumcarbid kann nicht geschmolzen werden, im Vakuum oder unter Schutzgas zersetzt es sich oberhalb von 2700-3000°C. Siliziumcarbid ist bis ca. 800°C gegen Oxidation durch Sauerstoff beständig, wird aber durch Chlor bereits bei 100°C angegriffen. SiC ist ein Halbleiter mit einer Bandlücke von 2.4 bis 3.3 eV. SiC wird hauptsächlich durch CVD (chemical vapour deposition) hergestellt. Dabei werden leichtflüchtige Carbosilane (z.B. Methyltrichlorsilan, CH3SiCl3) an heißen Oberflächen in einer Wasserstoff-Atmosphäre zersetzt, wodurch sich β-Siliziumcarbid auf der Oberfläche abscheidet. Beim älteren Acheson-Verfahren wird ein Gemisch aus Quarzsand und Koks im elektrischen Ofen auf ca. 2300°C erhitzt. Dabei bildet sich hexagonales α-Siliziumcarbid:
SiO2 + 3 C Siliziumcarbid wird wegen seiner Härte als Polier- und Schleifmittel eingesetzt, und in Keramiken und für feuerfeste Steine verwendet. Weiters wird es zum Legieren von Eisen mit Silizium und Kohlenstoff verwendet. Die Halbleitereigenschaften von SiC nutzt man zur Herstellung von Varistoren, schnellen Schottky-Dioden, oder Feldeffekttransistoren die hohe Strahlungsdosen aushalten müssen. Blaue Leuchtdioden auf SiC-Basis haben allerdings einen sehr schlechten Wirkungsgrad und können gegen Nitrid-Halbleiter nicht bestehen. | |||||
 Kohlenstoffgruppe
Kohlenstoffgruppe  Silizium
Silizium  Siliziumcarbid
Siliziumcarbid
Last Update: 2013-08-08



 SiC + 2 CO
SiC + 2 CO