| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Übergangselemente Übergangselemente  Scandiumgruppe Scandiumgruppe  Actinoide Actinoide  Plutonium Plutonium |
|||||||||||||||||||||
| Siehe auch: Periodensystem der Elemente, Neptunium, Americium | |||||||||||||||||||||






|
|||||||||||||||||||||
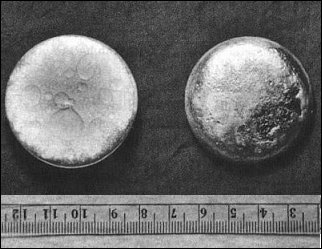
PlutoniumAutor: H. Lohninger
GeschichtePlutonium wurde 1940 von G.T. Seaborg, E.M. McMillan, J.W. Kennedy, und A.C. Wahl durch Beschuss von Uran mit Deuterium entdeckt. Zwei Jahre später wurde Plutonium auch in Spuren in Pechblende und Carnotit gefunden. Vorkommen und GewinnungObwohl Plutonium in der Natur in Spuren vorkommt, stammt der bei weitem größte Teil des Plutoniums aus anthropogenen Quellen (aus Kernwaffenversuchen und Unfällen und aus der Wiederaufbereitung von abgebrannten Kernbrennstäben). Man schätzt die Menge an Plutonium, das in Kernwaffen "gelagert" ist, auf weltweit ca. 100 t, insgesamt existieren rund 250 t waffenfähiges Plutonium.Plutonium entsteht in Kernkraftwerken nach folgender Reaktion:
238U + n Eigenschaften
Plutonium ist ein silbrig-graues Metall, das an Sauerstoff und feuchter Luft relativ schnell oxidiert wird. Plutonium wird von Salzsäure leicht gelöst, von Flusssäure aber nur sehr langsam (durch Passivierung der Oberfläche). Salpetersäure erzeugt ebenfalls eine Passivierung. Schwefelsäure löst Plutonium nur langsam. Plutonium kommt in sechs allotropen Modifikationen vor, die verschiedene Kristallstrukturen aufweisen und sich in der Dichte deutlich unterscheiden (16.0 bis 19.86 g/cm3). α-Plutonium, das im Temperaturbereich bis 122°C vorliegt, weist die größte Dichte auf. VerwendungPlutonium ist das in der technischen Anwendung wichtigste Transuranelement, da es sowohl für Kernwaffen als auch für Kernkraftwerke in großem Umfang eingesetzt wird. Dabei wird zwischen waffenfähigem Plutonium (239Pu mit maximal 7% 240Pu) und Plutonium für Kraftwerke (240Pu-Gehalt größer als 7%). In U-Booten werden Atombomben mit "Supergrade"-Plutonium verwendet (weniger als 2% 240Pu), um die Strahlenbelastung der Mannschaft möglichst niedrig zu halten: Während die Alphastrahlung des 239Pu leicht abzuschirmen ist, zerfällt 240Pu spontan unter Aussendung von Gammaquanten, so dass Plutonium mit hohem 240Pu-Anteil nur mit hohem Aufwand (wenn überhaupt) abgeschirmt werden kann.238Pu ist ein langlebiger Alphastrahler (th= 87.7 Jahre), der als Nuklidbatterie in Raumsonden eingesetzt wird. Gesundheitliche Aspekte und GefahrenmomenteDa Plutonium eine hohe spezifische Aktivität aufweist und in Knochen und Leber eingebaut wird, ist es selbst in kleinsten Mengen sehr gefährlich. Darum werden alle Aktivitäten mit Plutonium in Glove-Boxes durchgeführt die Unterdruck aufweisen, ebenso wird das Labor in dem die Glove-Box steht auf Unterdruck gehalten. Beim Befüllen oder Entladen der Glove-Box sind Gasmasken zu tragen, da selbst kleinste Mengen von inhaliertem Plutoniumstaub (< 1µg) tödlich sind.
Weiters muss man bei Plutonium sehr darauf achten, nicht die kritische Masse zu erreichen. Speziell in wässriger Lösung ist die kritische Masse von 239Pu, bedingt durch Neutronenreflexion sehr niedrig (531 g). Metallisches 239Pu hat dagegen eine kritische Masse von etwa 10 kg. Die kritische Masse kann sich aber durch in der Nähe befindliche Neutronenreflektoren deutlich erniedrigen, was in der Vergangenheit schon zu einigen Unfällen mit tödlichem Ausgang geführt hat.
|
|||||||||||||||||||||
Home  Übergangselemente Übergangselemente  Scandiumgruppe Scandiumgruppe  Actinoide Actinoide  Plutonium Plutonium |
|||||||||||||||||||||
Last Update: 2013-08-08


 239U
239U