| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Kohlenstoffgruppe Kohlenstoffgruppe  Kohlenstoff Kohlenstoff  Diamant Diamant |
|||
| Siehe auch: Kohlenstoff, Graphit | |||






|
|||
DiamantAutor: Hans Lohninger
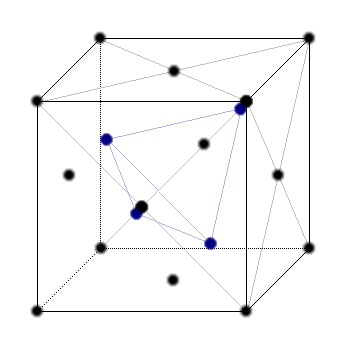
Struktur des DiamantsDie Kristallstruktur des Diamants beruht auf einem kubisch-flächenzentrierten Gitter, das zusätzlich an vier der Tetraederlücken (blau in der Abbildung unten) mit einem Atom besetzt ist. Durch diese Anordnung ist jedes C-Atom symmetrisch von vier Nachbarn umgeben und liegt im Zentrum eines Tetraeders. Die vier Bindungen sind vollständig sp3-hybridisiert und weisen eine sehr hohe Bindungsenegie auf.
EigenschaftenDiamant ist das härteste bekannte Mineral und dient als Referenz in der Mohs'schen Härteskala (Härte 10). Diamant weist eine hohe Lichtbrechung und die beste Wärmeleitung aller bekannten Minerale auf. Diamant ist in reinem Zustand farblos, weist aber als natürlicher Diamant oft Färbungen auf, die von Spuren von Verunreinigungen herrühren.Gewinnung und Herstellung
Verwendung von DiamantDiamant wird neben der Schmuckindustrie hauptsächlich in der Industrie als Schleifmittel und für Schneidwerkzeuge eingesetzt. Wichtig ist auch der Einsatz von Diamant in der Infrarot-Spektroskopie, da Diamant Infrarot nur wenig absorbiert.
|
|||
Home  Kohlenstoffgruppe Kohlenstoffgruppe  Kohlenstoff Kohlenstoff  Diamant Diamant |
|||
Last Update: 2013-08-08