| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Kohlenstoffgruppe Kohlenstoffgruppe  Kohlenstoff Kohlenstoff  Graphit Graphit |
|||||||
| Siehe auch: Kohlenstoff, Diamant | |||||||






|
|||||||
GraphitAutor: Hans Lohninger
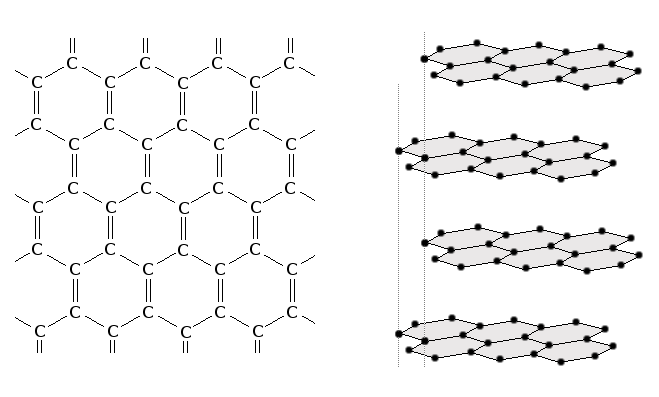
Struktur des GraphitsGraphit besteht aus übereinandergelagerten Schichten ebener Kohlenstoff-Schichten, die hexagonal verknüpft sind. Man nennt ein solche Schicht Graphen (Aussprache: Betonung auf die zweite Silbe ähnlich wie z.B. "Ethen"). Graphen ist auch als Einzelschicht existenzfähig und ist momentan im Interesse der Grundlagenforschung, da Graphen einige sehr interessante Eigenschaften aufweist. So wird eine Doppelschicht Graphen halbleitend, wobei die Bandlücke vom angelegten Feld abhängt.Graphit existiert in zwei verschiedenen Modifikationen bei denen sich die Anordnung der Graphenlagen zueinander unterscheidet: α-Graphit (hexagonaler Graphit) besitzt eine zweilagige Struktur (siehe Abbildung unten rechts), β-Graphit (rhomboedrischer Graphit) zeigt eine dreilagige Struktur, wo jeweils jede dritte Schicht exakt übereinander liegt.
Der Abstand zwischen den Atomen innerhalb einer Graphenschicht beträgt 0.142 nm, die Schichten selbst haben einen Abstand von 0.335 nm. Die Bindungen in der Graphenschicht sind sp2-hybridisiert, das vierte Außenelektron befindet sich in delokalisierten π-Molekülorbitalen und ist der Grund für die sehr gute elektrische Leitfähigkeit des Graphits entlang seiner Schichten. Die einzelnen Schichten werden durch schwache π-Wechselwirkungen und van-der-Waals-Kräfte zusammengehalten. Durch die schwache Bindung zwischen den Schichten erklärt sich die leichte Spaltbarkeit und die Schmierwirkung des Graphits. EigenschaftenNatürlicher Graphit bildet eine grau-schwarze, stark abfärbende Masse, die sich fettig anfühlt. Graphit leitet den elekrischen Strom parallel zu den Schichten sehr gut und ist diesbezüglich mit Metallen vergleichbar. Quer zu den Schichten sinkt die Leitfähigkeit um den Faktor 10000. Graphit ist ein sehr guter Wärmeleiter und ist thermisch und chemisch sehr beständig. Graphit-Tiegel werden deswegen z.B. für das Schmelzen von Metallen verwendet. Graphit wird von Sauerstoff erst oberhalb von 500°C angegriffen. Graphit weist einen hohen Wirkungsquerschnitt für Neutronen auf und eignet sich deshalb zum Einsatz als Moderator in Kernkraftwerken.(1)Natürlicher GraphitNatürlicher Graphit kommt in metamorphen Gesteinen vor. Die größten Graphitproduzenten sind China und Indien, die zusammen rund 2/3 der Weltproduktion abbauen. Da natürlicher Graphit nur etwa 30 bis 50% Kohlenstoff enthält, wird das Gestein gemahlen und der Kohlenstoff durch Flotation vom Gestein getrennt.ElektrographitKünstlicher Graphit, sog. Elektrographit, nimmt den bei weitem größten Anteil an der gesamten Weltproduktion von Graphit an. Dieser wird aus Koks durch "Graphitierung" gewonnen; dabei wird z.B. Petrolkoks zuerst bei 1400°C gebrannt, dann gemahlen und mit Teer vermengt. Die entstehende zähe Masse wird bei 1000-1300 °C vorgebrannt und dann durch elektrischen Strom auf 2600 bis 3000 °C aufgeheizt.Verwendung von GraphitGraphit wird aufgrund seiner vielfältigen charakteristischen Eigenschaften in gänzlich unterschiedlichen Einsatzbereichen verwendet. Dazu gehört die Verwendung als Bleistiftminen (Graphit färbt leicht ab), die Erzeugung von Bürsten für elektrische Motoren (sehr gute Leitfähigkeit, gute Gleiteigenschaften), die Verwendung als Schmiermittel, die Erzeugung von feuerfesten Tiegeln und der schon erwähnte Einsatz als Moderator in Kernkraftwerken. Weiters wird besonders Elektrographit in sehr großen Mengen in der Schwerindustrie zum Auskleiden von Öfen, als Elektrodenmaterial für Elektrostahlöfen und für Elektrolyseanlagen verwendet.
|
|||||||
Home  Kohlenstoffgruppe Kohlenstoffgruppe  Kohlenstoff Kohlenstoff  Graphit Graphit |
|||||||
Last Update: 2013-08-08