| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Grundlegende Begriffe Grundlegende Begriffe  Atomorbitale Atomorbitale |
|||||||||
| Siehe auch: Periodensystem | |||||||||






|
|||||||||
AtomorbitaleAutor: Hans Lohninger Atomorbitale können entsprechend der Quantentheorie mit vier Kennzahlen (sog. Quantenzahlen) beschrieben werden, die mit n (Hauptquantenzahl), l (Nebenquantenzahl), ml (Magnetquantenzahl) und ms (Spinquantenzahl) bezeichnet werden:
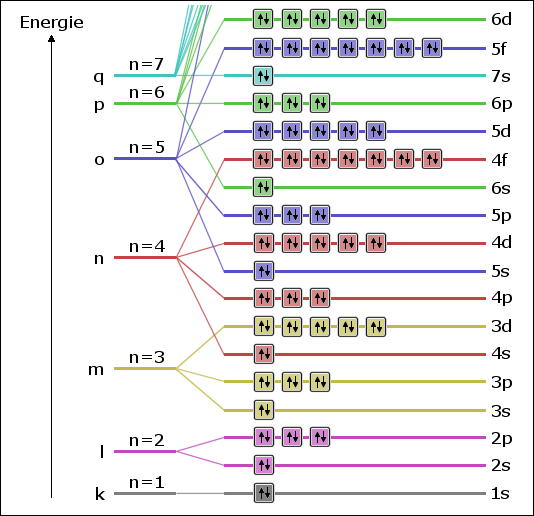
Für die Besetzung der Atomorbitale eines Atoms im Grundzustand mit Elektronen gilt, dass zuerst immer die Orbitale mit niedriger Energie aufgefüllt werden. Gibt es mehrere Atomorbitale mit der selben potentiellen Energie, so werden diese zuerst mit Elektronen derselben Spinquantenzahl gefüllt. Da die potentielle Energie eines Elektrons ohne äußere Felder ausschließlich von der Haupt- und der Nebenquantenzahl abhängt, bestimmen diese beiden Quantenzahlen die Reihenfolge des Auffüllens der Orbitale. Allerdings wird die Reihenfolge durch die Überschneidung der Energiezustände der einzelnen Schalen etwas komplizierter. So weist die Unterschale 4s eine niedrigere Energie auf als die Unterschale 3d. Die folgende Abbildung zeigt das Energieschema der einzelnen Atomorbitale, wobei die Energieachse nicht linear ist, sondern nur ordinal zu verstehen ist:
Die tatsächliche Elektronenbesetzung wird durch folgende Schreibweise symbolisiert: Jede Unterschale wird durch Haupt- und Nebenquantenzahl beschrieben, die Zahl der Elektronen in der betreffenden Unterschale wird durch eine Hochzahl angegeben; die einzelnen Unterschalen werden meist zur besseren Lesbarkeit mit Abständen getrennt geschrieben. So hat zum Beispiel Stickstoff im Grundzustand folgende Elektronenbesetzung:1s2 2s2 2p3. Bei Elementen mit hoher Ordnungszahl würde diese Schreibweise zu sehr langen, unlesbaren Zeilen führen. Man kürzt daher vollständig aufgefüllte Schalen mit dem Symbol des jeweiligen Edelgases, das diesen Schalen entspricht, in eckigen Klammern ab. Die Orbitalbesetzung von Stickstoff wird dann also als [He] 2s2 2p3 geschrieben. Cobalt schreibt man in dieser gekürzten Schreibweise mit [Ar] 3d7 4s2.
Betrachtet man nun die chemischen Elemente geordnet nach deren Ordnungszahl (= Zahl der Protonen im Kern, bzw. Zahl der Elektronen in der Schale), so sieht man, dass die Atomorbitale entsprechend ihrer potentiellen Energie beginnend mit der niedrigsten Energie aufgefüllt werden. Wasserstoff hat also die Elektronenbesetzung 1s1, Helium 1s2, Lithium 1s2 2s1, Beryllium 1s2 2s2, Bor 1s2 2s2 2p1, usw. Die Edelgase weisen jeweils vollständig gefüllte Schalen auf. Schreibt man alle Elemente mit gleicher Elektronenzahl der noch nicht vollständig aufgefüllten Schalen untereinander und alle Elemente mit gleicher vollständig gefüllter Schale nebeneinander (mit aufsteigender Ordnungszahl), so erhält man das Periodensystem der Elemente.
|
|||||||||
Home  Grundlegende Begriffe Grundlegende Begriffe  Atomorbitale Atomorbitale |
|||||||||
Last Update: 2013-08-08