| Anorganische Chemie ist eine frei verfügbare Einführung in die anorganische Chemie. Details zum Buch finden Sie im Editorial.... |

|

Home  Grundlegende Begriffe Grundlegende Begriffe  Wasserstoffbrückenbindung Wasserstoffbrückenbindung |
|||
| Siehe auch: Wasser - Chemisch-Physikalische Eigenschaften | |||






|
|||
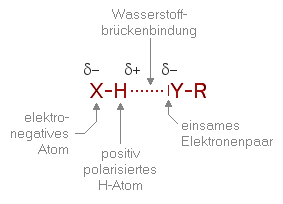
WasserstoffbrückenbindungAutor: Hans Lohninger Unter Wasserstoffbrückenbindung versteht man die elektrostatische Anziehung zwischen einem partiell positiv geladenem Wasserstoffatom und einen elektronegativem Atom einer anderen funktionellen Gruppe oder eines anderen Moleküls. Voraussetzung für die Entstehung von Wasserstoffbrückenbindungen ist zum einen die (positive) Polarisierung des betreffenden Wasserstoffatoms durch ein an das H-Atom gebundenes, stark elektronegatives Atom (O, N, oder F) und zum anderen das Vorhandensein geeigneter Atome die eine negative Teilladung tragen und/oder ein einsames Elektronenpaar aufweisen. Allgemein formuliert kann man folgendes simplifizierte Modell verwenden:
Das Wasserstoffatom ist dabei an das elektronegative Atom X gebunden und wird durch das Elektronenpaar des Atoms Y angezogen.
Wasserstoffbrückenbindungen weisen typische Bindungsenergien von 5 bis 40 kJ/mol auf (bei Beteiligung von Ionen bis zu 140 kJ/mol) und sind damit stärker als Van-der-Waals-Wechselwirkungen, aber schwächer als klassische kovalente oder ionische Bindungen. Die schwächeren Wasserstoffbrückenbindungen weisen auch deutlich größere Bindunglängen auf als kovalente Bindungen. So ist die Bindungslänge der Wasserstoffbrücken in Eis ca. 180 pm während die kovalente OH-Bindung im Wassermolekül rund 100 pm lang ist. Wasserstoffbrückenbindungen sind normalerweise linear, da nur so die abstoßenden Kräfte zwischen den negativ polarisierten Atomen X und Y minimal sind während gleichzeitig die Anziehung zwischen H und Y maximal wird. In den meisten Wasserstoffbrücken weist das Wasserstoffatom eine Koordinationszahl von zwei auf, allerdings gibt es etliche Verbindungen (wie z.B. kristalline Kohlehydrate oder Aminsosäuren) in denen die Koordinationszahl 3 ist, die Wasserstoffbrücke also gegabelt ist. Wasserstoffbrücken können sowohl intermolekular (z.B. in Wasser oder in Essigsäure) aber auch intramolekular (z.B. in Proteinen oder in Salicylaldehyd) auftreten und tragen ganz wesentlich zu den Eigenschaften der jeweiligen Substanzen bei. So ist der vergleichsweise hohe Siedepunkt von Wasser, Ammoniak und Fluorwasserstoff auf Wasserstoffbrücken zurückzuführen.
Weiters spielt die Wasserstoffbrückenbindung eine große Rolle bei der Faltung von Proteinen und der Basenpaarung in der DNA. Dabei bilden sich Wasserstoffbrücken zwischen Guanin und Cytosin, und zwischen Adenin und Thymin aus. Die Wasserstoffbrückenbindung spielt auch eine wesentliche Rolle bei der Adsorption von Wasser an Oberflächen. Sie führt dazu, dass sich in normaler atmosphärischer Umgebung das adsorbierte Wasser schnell in hexagonalen Doppellagenstrukturen organisiert.
|
|||
Home  Grundlegende Begriffe Grundlegende Begriffe  Wasserstoffbrückenbindung Wasserstoffbrückenbindung |
|||
Last Update: 2013-08-08


 Betrachtet man
Betrachtet man 